Khi học môn Hóa, các em sẽ được nghe nhiều đến khái niệm cân bằng hóa học. Đây cũng là nội dung quan trọng mà các em cần nắm vững để giải quyết các bài toán trong chương trình Hóa học lớp 10 nói riêng, Hóa THCS và THPT nói chung. Vậy, cân bằng hóa học là gì? Trong bài viết này, Marathon Education sẽ cung cấp cho các em đầy đủ những kiến thức về lý thuyết này.
Khi học về cân bằng hóa học, các em sẽ được biết đến 2 loại phản ứng. Đó chính là phản ứng một chiều và phản ứng thuận nghịch.
Đúng như tên gọi, phản ứng một chiều là phản ứng chỉ xảy ra theo đúng một chiều từ trái sang phải. Điều này có nghĩa là sau phản ứng, chất phản ứng sẽ biến đổi thành chất sản phẩm và không xảy ra phản ứng theo chiều ngược lại. Khi viết phương trình hóa học, các em cần sử dụng mũi tên để chỉ chiều phản ứng.
2KClO_3 \xrightarrow{t^\circ} 2KCl+3O_2Ngược lại, phản ứng xảy ra theo 2 chiều trái ngược nhau trong cùng một điều kiện được gọi là phản ứng thuận nghịch. Cụ thể, chất phản ứng biến đổi thành chất sản phẩm và ngược lại, chất sản phẩm cũng sẽ phản ứng với nhau tạo thành chất tham gia phản ứng. Vì thế, khi viết phương trình hoá học, các em nên sử dụng hai mũi tên ngược chiều nhau.
Cl_2+H_2O ⇌ HCl+HClO
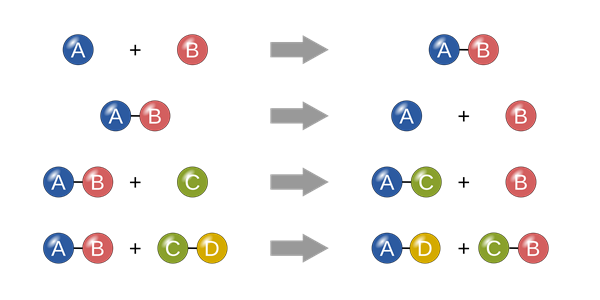
Cân bằng hóa học là một trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận và phản ứng nghịch bằng nhau.
Như vậy, cân bằng hóa học được xác định là cân bằng động. Ở trạng thái cân bằng luôn có sự xuất hiện của chất phản ứng và chất sản phẩm.
>>> Xem thêm:
Hệ đồng thể là hệ gồm các chất có tính chất vật lý và tính chất hóa học như nhau ở tất cả các vị trí trong hệ. Ví dụ, hệ gồm các chất tan trong dung dịch, hệ gồm các chất khí.
Chẳng hạn, một phản ứng thuận nghịch được xảy ra như sau:
aA + bB ⇌ cC + dD
Trong đó, A, B, C, D là những chất tan trong dung dịch hoặc chất khí có phản ứng ở trạng thái cân bằng. Ta có:
K = \frac{[C]^c.[D]^d}{[A]^a.[B]^b}[A], [B], [C], [D] là theo thứ tự là nồng độ mol/l của các chất A, B, C, D và a, b, c, d là hệ số của các chất trong phương trình phản ứng.
Hằng số cân bằng K của phản ứng xác định chỉ phụ thuộc vào nhiệt độ mà không phụ thuộc vào nồng độ chất phản ứng.
Nếu cân bằng hóa học được thiết lập giữa các chất khí thì các em có thể thay nồng độ các chất trong biểu thức tính K bằng áp suất riêng phần của hỗn hợp.
Khác với hệ đồng thể, hệ dị thể là hệ gồm các chất có tính chất vật lý và hóa học không giống nhau ở mọi vị trí ở trong hệ. Ví dụ, hệ bao gồm các chất tan trong nước và chất rắn, hệ bao gồm chất khí và chất rắn.
Các em hãy xét hệ cân bằng hóa học sau:
C_{(r) }+ CO_{2\ (k) } ⇌ 2CO_{ (k)}\\
K = \frac{[CO]^2}{[CO_2]}Nồng độ các chất rắn được coi là hằng số.
Sự dịch chuyển cân bằng hóa học là sự phá vỡ trạng thái cân bằng cũ và chuyển sang trạng thái cân bằng mới. Nguyên nhân chính là do các yếu tố bên ngoài tác động đến cân bằng.
Các em hãy xét cân bằng hóa học sau:
C_{(r)} + CO_{2\ (k)} ⇌ 2CO_{(k)}Khi CO2 tăng thì cân bằng sẽ chuyển dịch theo chiều thuận (làm giảm CO2). Ngược lại, khi giảm CO2 thì cân bằng này sẽ chuyển dịch theo chiều nghịch, tức là chiều làm tăng CO2.
Vì thế, khi tăng hay giảm nồng độ một chất trong cân bằng hóa học thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động của chất đó theo hướng tăng hoặc giảm nồng độ. Các em cũng nên lưu ý, chất rắn là chất không làm ảnh hưởng đến cân bằng của hệ.
Các em hãy xét cân bằng hóa học sau:
N_2O_{4\ (k)} ⇌ 2NO_{2\ (k)}Khi áp suất tăng thì cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất. Khi áp suất giảm thì cân bằng sẽ chuyển dịch theo chiều làm tăng áp suất.
Như vậy, khi tăng hay giảm áp suất chung của hệ cân bằng thì cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm áp suất đó.
Các em cần lưu ý rằng, nếu số mol khí ở 2 vế bằng nhau (hoặc không có chất khí tham gia phản ứng) thì áp suất không ảnh hưởng đến cân bằng.
H_{2\ (k)} + I_{2 (k)} ⇌ 2HI_{ (k)}Yếu tố nhiệt độ liên quan đến phản ứng thu nhiệt và phản ứng tỏa nhiệt. Cụ thể, phản ứng thu nhiệt là phản ứng lấy thêm năng lượng để tạo ra sản phẩm, được kí hiệu là ΔH>0. Phản ứng tỏa nhiệt là phản ứng giảm bớt năng lượng, được kí hiệu là ΔH<0.
\begin{array}{ccc}
ΔH= −58kJ&N_2O_{4\ (k) }⇌ NO_{2\ (k)}&ΔH = +58kJ
\end{array}Xét phản ứng trên các em sẽ thấy:
Phản ứng thuận thu nhiệt vì ΔH = +58kJ > 0
Phản ứng nghịch tỏa nhiệt vì ΔH= −58kJ < 0
Tóm lại, nhiệt độ có ảnh hưởng đến cân bằng hóa học. Khi nhiệt độ tăng, cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt (để giảm tác động tăng nhiệt độ). Khi nhiệt độ giảm, cân bằng sẽ chuyển dịch theo chiều phản ứng tỏa nhiệt (để giảm tác động giảm nhiệt độ).
Theo nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê thì một phản ứng thuận nghịch đang ở trạng thái cân bằng nếu chịu một tác động từ bên ngoài như sự biến đổi nồng độ, áp suất hay nhiệt độ thì cân bằng hóa học sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Chất xúc tác không ảnh hưởng đến cân bằng hóa học. Sự xuất hiện của chất xúc tác làm tăng tốc độ phản ứng thuận và phản ứng nghịch với số lần bằng nhau. Khi phản ứng chưa cân bằng thì chất xúc tác sẽ làm cho cân bằng được thiết lập nhanh hơn.
Để học tốt môn Hoá, một phương pháp học tập được nhiều em học sinh áp dụng hiện nay là kết hợp học chính khóa với đăng ký thêm khóa học online trực tuyến. Bằng cách này, các em có thể nắm chắc nội dung cơ bản của môn học đồng thời cũng cố và bổ sung thêm nhiều kiến thức khác. Trong đó, Marathon Education là nền tảng học online livestream Toán – Lý – Hóa dành cho học sinh cấp 3 được rất nhiều học sinh và phụ huynh tin tưởng lựa chọn.
Tại Marathon, các lớp học Toán – Lý – Hóa 10 – 11 – 12 đều do các giáo viên thuộc TOP 1% giáo viên dạy giỏi toàn quốc đứng lớp. Các thầy cô đều là những người có trình độ Thạc sĩ trở lên với hơn 10 năm kinh nghiệm giảng dạy. Đặc biệt, trong hoạt động giáo dục, các thầy cô cũng đạt được nhiều thành tích xuất sắc.
Khác với các nền tảng học online được thu, phát lại, các lớp học của Marathon là online livestream. Vì thế, trong quá trình học, các em sẽ được tương tác với thầy cô như đang học trực tiếp. Hơn nữa, đội ngũ Cố vấn học tập của Marathon cũng sẽ luôn sát cánh, đồng hành cùng các em để giải đáp kịp thời mọi thắc mắc. Ngoài ra, khi đăng ký học tại Marathon, các em được trang bị sổ tay tổng hợp kiến thức Toán – Lý – Hóa “siêu xịn sò” để hỗ trợ việc học và ôn tập.
Đặc biệt, Marathon Education là nền tảng học online có ứng dụng những công nghệ mới nhất. Chất lượng các lớp luôn được đảm bảo với đường truyền ổn định, không bị giật/lag, hình ảnh sắc nét, âm thanh rõ ràng.
Hiện, Marathon Education đang có chương trình ưu đãi học phí lên đến 39% cho các em đăng ký học livestream trực tuyến Toán – Lý – Hóa lớp 10 – 11 – 12 từ hôm nay đến ngày 15/02/2022. Các em nhanh tay nhận lấy cơ hội này nhé!
Từ những thông tin mà các Marathon Education đã chia sẻ ở trên, chắc hẳn các em đã có đủ tự tin để trả lời câu hỏi cân bằng hóa học là gì. Các em hãy cố gắng học thuộc, ghi nhớ toàn bộ lý thuyết liên quan đến cân bằng hóa học vì đây là kiến thức quan trọng sẽ hỗ trợ các em rất nhiều trong quá trình giải bài tập. Chúc các em học tập tốt!